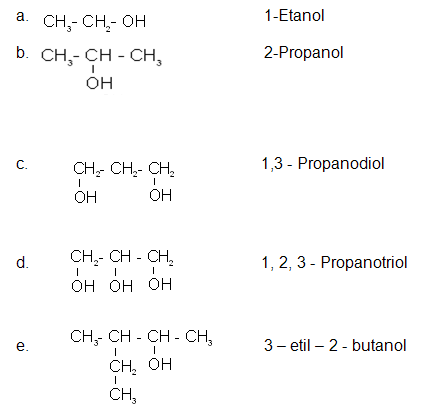FORMULACIÓN Y NOMENCLATURA DE LOS COMPUESTOS ORGÁNICOS
<!--[if !supportLists]-->o <!--[endif]-->ALCANO
Amida (-CON=). Su actividad es muy reducida en comparación de otros compuestos orgánicos.(1)
Todos los enlaces dentro de las moléculas de alcano son de tipo simple o sigma, es decir, covalentes por comparición de un par de electrones en un orbital s, por lo cual la estructura de un alcano sería de la forma:
En cada línea de nuestra imagen se presenta un enlace covalente, ejemplos de alcanos son etano, propano, butano con dos, tres y cuatro átomos de carbono respectivamente. Los nombre que se les asignan son debido, a los números griegos: pentano, hexano, heptano...
La nomenclatura se basa en identificar a las cadenas hidrocarbonadas. Las cadenas de hidrocarburos saturados lineales son nombradas sistemáticamente con un prefijo numérico griego que denota el número de átomos de carbono, y el sufijo "-ano".
<!--[if !supportLists]-->o <!--[endif]-->Acidos carboxilico
Los ácidos carboxílicos constituyen un grupo de compuestos que se caracterizan porque poseen un grupo funcional llamado grupo carboxilo o grupo carboxi (–COOH); se produce cuando coinciden sobre el mismo carbono un grupo hidroxilo (-OH) y carbonilo (C=O). Se puede representar como COOH ó CO2H.
Los derivados de los ácidos carboxílicos tienen como formula general R-COOH. Tiene propiedades ácidas; los dos átomos de oxígeno son electronegativos y tienden a atraer a los electrones del átomo de hidrógeno del grupo hidroxilo con lo que se debilita el enlace, produciéndose en ciertas condiciones, una ruptura heterolítica cediendo el correspondiente protón o hidrón, H+, y quedando el resto de la molécula con carga -1 debido al electrón que ha perdido el átomo de hidrógeno, por lo que la molécula queda como R-COO-.
<!--[if !vml]--> <!--[endif]-->
<!--[endif]-->
<!--[if !supportLists]-->o <!--[endif]-->AMINAS
El ENLACE QUÍMICO EN LOS COMPUESTOS ORGÁNICOS
Los enlaces covalentes son las fuerzas que mantienen unidos entre sí los átomos no metálicos (los elementos situados a la derecha en la tabla periódica -C, O, F, Cl, ...)(11) Este enlace se produce cuando átomos de elementos metálicos (especialmente los situados más a la izquierda en la tabla periódica -períodos 1, 2 y 3) se encuentran con átomos no metálicos (los elementos situados a la derecha en la tabla periódica -especialmente los períodos 16 y 17).
En este caso los átomos del metal ceden electrones a los átomos del no metal, transformándose en iones positivos y negativos, respectivamente. Al formarse iones de carga opuesta éstos se atraen por fuerzas eléctricas intensas, quedando fuertemente unidos y dando lugar a un compuesto iónico. Estas fuerzas eléctricas las llamamos enlaces iónicos.
<!--[if !supportLists]-->o <!--[endif]-->ENLACE COVALENTE COORDINADO
Bibliografías:
<!--[if !supportLists]-->o <!--[endif]-->ENLACE COVALENTE
Un enlace covalente se produce por el compartimiento de electrones entre dos o más átomos, los electrones de enlace son compartidos por ambos átomos.
Las aminas son compuestos químicos orgánicos que se consideran como derivados del amoníaco y resultan de la sustitución de los hidrógenos de la molécula por los radicales alquilo.
Su nomenclatura se usa la designación de amina primaria secundaria o terciaria para referirnos al número de grupos alquilos que están unidos al nitrógeno. Así, si la amina tiene un grupo alquilo y dos hidrógenos se le conocen como primaria, si tiene dos alquilos y un hidrógeno, secundaria y con tres grupos alquilo sin hidrógeno, terciaria. Debido a que tiene un par electrónico, puede formar compuestos tetrasustituidos, donde el átomo de nitrógeno queda cargado positivamente, y se les conoce como amina cuaternarias. Es importante notar que esta denominación se refiere al número de sustituyentes que tiene el átomo de nitrógeno y no como en el caso de los alcoholes al tipo de carbono sobre el cual se encuentra. En el caso de los alcoholes tendremos; alcoholes primario si el OH está sobre un carbono primario, alcohol secundario si se encuentra sobre un carbono secundario y alcohol terciario si está sobre un carbono terciario. (8)
<!--[if !supportLists]-->o <!--[endif]-->ALQUENO
Los alquenos son hidrocarburos insaturados que tienen uno o varios dobles enlaces carbono-carbono en su molécula. Se puede decir que un alqueno no es más que un alcano que ha perdido dos átomos de hidrógeno produciendo como resultado un enlace doble entre dos carbonos.(2)
La nomenclatura que se aplica a estos compuestos son aquellos que se sustituye la terminación -eno sistemática por -ileno, como por ejemplo; eteno que en ocasiones se llama etileno, o propeno por propileno.
Los alquenos presentan isomería cis/trans. En alquenos tri y tetra sustituidos se utiliza la notación Z/E
Los alquenos son planos con carbonos de hibridación sp2. El doble enlace está formado por un enlace σ que se consigue por solapamiento de híbridos sp2 y un enlace π que se logra por solapamiento del par de orbitales p perpendiculares al plano de la molécula.(3)
Los dobles enlaces se estabilizan por híper conjugación, de modo que un alqueno es tanto más estable cuantos más sustituyentes partan de los carbonos sp2.
Los alquenos se obtienen mediante reacciones de eliminación a partir de haloalcanos y mediante deshidratación de alcoholes.
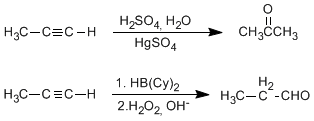
<!--[if !supportLists]-->o <!--[endif]-->ALQUINOS
Los alacanos están compuestos por un triple enlace que está compuesto por dos enlaces π perpendiculares entre si, formados por orbitales p no hibridados y un enlace sigma formado por híbridos sp.
Los alquinos se nombran sustituyendo la terminación -ano del alcano por -ino. El alquino más pequeño es el etino o acetileno. Se elige como cadena principal la más larga que contenga el triple enlace y se numera de modo que este tome el localizador más bajo posible.(4)
Los alquinos se obtienen mediante reacciones de eliminación a partir de dihaloalcanos vecinales o geminales.
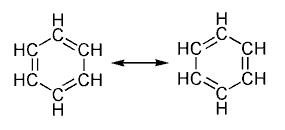
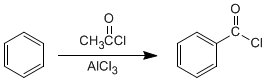
<!--[if !supportLists]-->o <!--[endif]-->COMPUESTOS AROMÁTICOS
Los compuestos aromáticos son estructuras planares por la conjugación de los electrones pi. Que le imparten propiedades especiales a este grupo funcional y estos son sistemas clínicos que poseen una gran energía de resonancia y en los que todos los átomos del anillo forman parte de un sistema conjugado único. (5)
Para nombrar los compuestos aromáticos siempre según las normas de IUPAC hay que tener en cuenta él numero de sustituyentes que ocupan la posición de los átomos de hidrógeno que componen la molécula del benceno.
Cuando se sustituye un único átomo de hidrógeno por un radical alquílico, un alógeno o cualquier otro tipo de sustitúyete, el nombre del compuesto se constituye poniendo en primer lugar el nombre del radical o sustitúyete y añadiendo después la palabra benceno. No obstante muchos de estos compuestos poseen un nombre propio especifico tradicional por ejemplo el metil-benceno es conocido como tolueno y el vinivelceno se llama tradicionalmente estireno.
<!--[if !supportLists]-->o <!--[endif]-->HALUROS DE ALQUILO Y HALUROS DE ARILO
Haluro de alquilo son compuestos que contienen halógeno unido a un átomo de carbono saturado con hibridación sp3. El enlace C-X es polar, y por tanto los halogenuros de alquilo pueden comportarse como electrófilos.(6)
<!--[if !supportLists]-->· <!--[endif]-->Halogenuro de ALQUILO:
Prefijo ALQ de Alcano, Alqueno ó Alquino. EJEMPLO:
CH3-CH2-Cl
<!--[if !supportLists]-->· <!--[endif]-->Halogenuro de ARILO:
Prefijo AR de Aromático. EJEMPLO:
-Cl
<!--[if !supportLists]-->· <!--[endif]-->Halogenuro de ACILO:
Prefijo AC de ácido. EJEMPLO:
CH3-C-Cl
<!--[if !supportLists]-->o <!--[endif]-->ALCOHOLES Y FENOLES
Los fenoles se forman al cambiar hidrógenos (-H) en alcanos por grupos hidroxilo (-OH). Se nombran terminando en -ol al hidrocarburo con igual número de carbonos, e indicando con un localizador la posición que ocupa el grupo -OH. Cuando actúan como sustituyentes se nombran como hidroxi-
IUPAC: sustituyendo el sufijo -ano por -ol en el nombre del alcano progenitor, e identificando la posición del átomo del carbono al que se encuentra enlazado el grupo hidroxilo.
Cuando el grupo alcohol es sustitúyete, se emplea el prefijo hidroxi-
Se utilizan los sufijos -diol, -triol, etc., según la cantidad de grupos OH que se encuentre.(7)
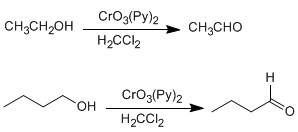
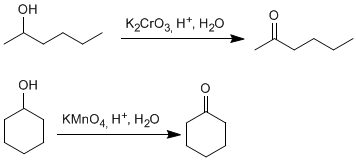
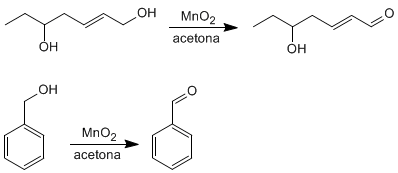
<!--[if !supportLists]-->o <!--[endif]-->ALDEHIDOS Y CETONAS
Se caracterizan por tener el grupo carbonilo <!--[if !vml]--> <!--[endif]-->
<!--[endif]-->
La fórmula general de los aldehídos es <!--[if !vml]--> <!--[endif]-->
<!--[endif]-->
La fórmula general de las cetonas es <!--[if !vml]--> <!--[endif]-->
<!--[endif]-->
Aldehídos
El sistema de nomenclatura corriente consiste en emplear el nombre del alcano correspondiente terminado en -al.
Cuando el grupo CHO es sustitúyete se utiliza el prefijo formil-.
También se utiliza el prefijo formil- cuando hay tres o más funciones aldehídos sobre el mismo compuesto .En esos casos se puede utilizar otro sistema de nomenclatura que consiste en dar el nombre de carbaldehído a los grupos CHO (los carbonos de esos CHO no se numeran, se considera que no forman parte de la cadena).Este último sistema es el idóneo para compuestos con grupos CHO unidos directamente a ciclos.
Cetonas
Para nombrar las cetonas tenemos dos alternativas:
- El nombre del hidrocarburo del que procede terminado en -ona .Como sustitúyete debe emplearse el prefijo oxo-.
- Citar los dos radicales que están unidos al grupo carbonilo por orden alfabético y a continuación la palabra cetona.
Estos átomos tienen muchos electrones en su nivel más externo (electrones de valencia) y tienen tendencia a ganar electrones más que a cederlos, para adquirir la estabilidad de la estructura electrónica de gas noble. Por tanto, los átomos no metálicos no pueden cederse electrones entre sí para formar iones de signo opuesto.(10)
<!--[if !supportLists]-->o <!--[endif]-->ENLACE IONICO

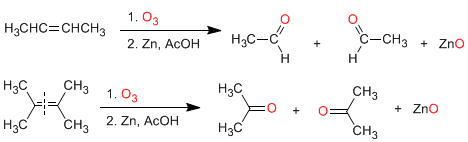
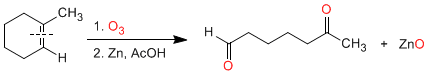
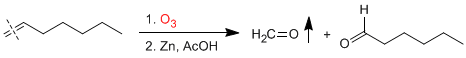
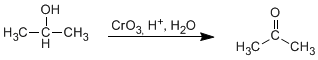




 Acidez y basicidad
Acidez y basicidad